Alzheimerforschung: Neue Erkenntnisse zur Bildung schädlicher Proteinklümpchen
Kleine Zusammenlagerungen von Proteinen, sogenannte Aβ-Oligomere, gelten als Hauptverdächtige für die Entstehung der Alzheimer-Demenz. Wo und unter welchen Bedingungen sie entstehen, ist bislang jedoch noch unklar.
Forschende der Heinrich-Heine-Universität Düsseldorf und des Forschungszentrums Jülich haben nun zusammen mit Partnern der Universität und Uniklinik Köln festgestellt, dass ein leicht saures Milieu für die Entwicklung förderlich ist, wie es in bestimmten Unterstrukturen der Nervenzellen vorliegt. Die Oligomere bilden sich darin rund 8.000-mal schneller als bei einem neutralen pH-Wert, wie die Forschenden in der Fachzeitschrift Nature Communications schreiben.
Die genauen Ursachen der Alzheimer-Demenz sind trotz intensiver Forschung immer noch nicht vollständig geklärt. Jahrzehntelang standen charakteristische Eiweißablagerungen im Fokus, die mit dem Mikroskop gut sichtbar sind und sich im Gehirn der Erkrankten nachweisen lassen. Heute haben Forschende dagegen vorrangig deren „kleinere Verwandte“, die Oligomere, im Blick. Dabei handelt es sich ebenfalls um Zusammenballungen des Peptids Amyloid-beta (Aβ), allerdings von deutlich geringerem Ausmaß, die typischerweise nur aus einigen wenigen Einheiten bestehen.
Aβ ist an sich nicht schädlich und kommt auch bei Gesunden vor. Es tendiert dazu, sich zu schädlichen Strukturen zusammenzufügen, etwa wenn Stoffwechselprozesse im Gehirn gestört sind. Die biochemischen Prozesse, die diese toxischen Oligomere auslösen, gelten als Auslöser der Alzheimer-Demenz. Es ist allerdings unklar, wo und wie diese Oligomere entstehen. Der Prozess ließ sich im Reagenzglas bis jetzt nicht realitätsnah nachvollziehen. Denn die dazu benötigten Mengen an Aβ sind weitaus größer als die Mengen, die in der Hirnflüssigkeit nachgewiesen wurden.
In der nun veröffentlichten Arbeit konnten die Forschenden jetzt zeigen, dass die Entstehung der Oligomere hochgradig vom pH-Wert abhängt. Unter leicht sauren Bedingungen bilden sie sich 8.000-mal schneller als bei neutralem pH-Wert. Ein solcher pH-Wert liegt etwa in bestimmten Unterstrukturen der Zellen vor, den Endosomen und Lysosomen: kleine Bläschen oder auch Vesikel, die für den Transport und Abbau von Stoffen in der Zelle eine zentrale Rolle spielen.
„Die Aβ-Mengen, die in diesen Zellbereichen gefunden wurden, reichen somit aus, um die Bildung der Aβ-Oligomere zu ermöglichen“, erklärt Wolfgang Hoyer von der Heinrich-Heine-Universität Düsseldorf und dem Forschungszentrums Jülich.
Endosomen und Lysosomen stehen bereits seit längerem im Fokus der Alzheimerforschung. Es sind die Orte, an denen einzelne Aβ-Moleküle durch Aufspaltung eines Vorläuferproteins überhaupt erst entstehen. Und es sind Sammelpunkte, zu denen von der Zelle aufgenommenes Aβ transportiert wird. „Unsere Ergebnisse legen nun nahe, dass Endosomen und Lysosomen zudem tatsächlich die Stellen sind, an denen Aβ-Oligomere bevorzugt gebildet werden,“ so Wolfgang Hoyer.
Studie liefert Erklärungen für Protein-Fehlverteilung
Die Forschenden konnten die schadhaften Aβ-Oligomere darüber hinaus mit einem weiteren Merkmal für Alzheimer in Verbindung bringen: So beobachten sie nach Zugabe der Aβ-Oligomere eine fehlerhafte Verteilung des Tau-Proteins innerhalb der Nervenzellen. Das Tau-Protein ist ein zweites, eng mit dem Fortschreiten der Alzheimer-Demenz verknüpftes Protein. Das Vorkommen an den falschen Stellen kann zu Störungen der Aktivität und Struktur von Nervenzellen führen.
„Die Fehlverteilung und andere pathologische Veränderungen von Tau sind maßgeblich für den Funktionsverlust der Nervenzellen und die kognitiven Einschränkungen bei Alzheimer-Patienten. Dass die hier beschriebenen Aβ-Oligomere diese pathologische Veränderung des Tau Proteins in Nervenzellen induzieren können, zeigt die hohe pathophysiologische Relevanz der Studie“, erklärt Hans Zempel vom Universitätsklinikum Köln.
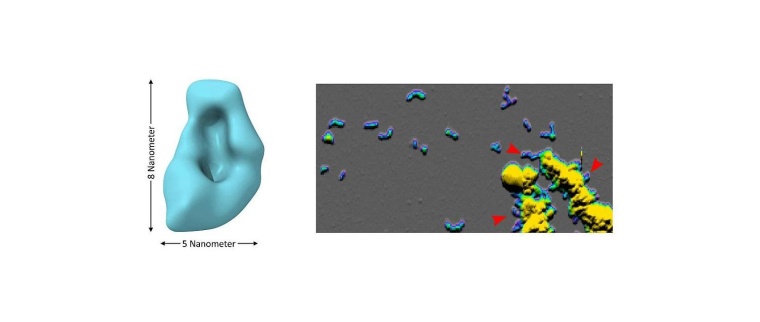
Mittels Kryo-Elektronenmikroskopie und Rasterkraftmikroskopie hat das Forscherteam zudem Größe und Form der Oligomere untersucht. „Die gewonnenen Erkenntnisse schaffen eine Grundlage, um die besonderen Eigenschaften und Wirkungen dieser kritischen Proteinaggregate besser entschlüsseln zu können“, erläutert Wolfgang Hoyer. Dies ist hilfreich für die Entwicklung von Diagnostik- und Therapiestrategien, die gezielt Oligomere ins Visier nehmen.