Erste Herzorganoide mit mehreren Kammern enthüllen Entwicklung und Erkrankung des Herzens
Jedes Jahr sterben 18 Millionen Menschen an Herzkrankheiten, aber die Entwicklung neuer Therapien steht vor einem Engpass: Es existiert kein physiologisches Modell des gesamten menschlichen Herzens - bis jetzt.
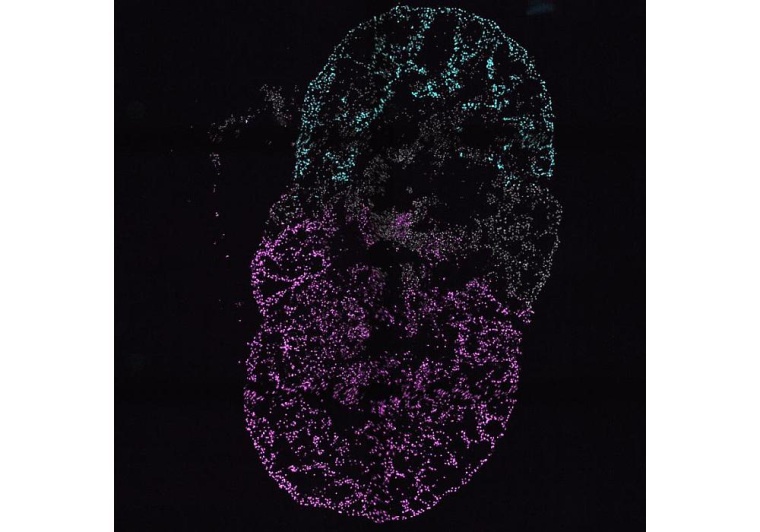
Ein neues Mehrkammer-Organoid, das die komplizierte Struktur des Herzens widerspiegelt, ermöglicht es Wissenschaftler*innen, Screening-Plattformen für die Entwicklung von Arzneimitteln voranzutreiben und die Entwicklung des Herzens zu verstehen. Die neuen Erkenntnisse, gewonnen mit in der Gruppe von Sasha Mendjan am Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften entwickelten Herzorganoid-Modellen, werden am 28. November in Cell veröffentlicht.
Herz-Kreislauf-Erkrankungen sind weltweit die häufigste Todesursache, aber nur wenige neue Therapien sind in Sicht. Ähnlich verhält es sich mit angeborenen Herzfehlern, die bei jedem 50. Neugeborenen auftreten - auch hier gibt es nur wenige Therapien, da wir die Entstehung von Herzfehlern kaum verstehen. Was zum Verständnis von Herzerkrankungen und Herzfehlbildungen fehlt, ist ein Modell, das die wichtigsten Regionen des menschlichen Herzens nachbildet. Das Mendjan-Team am IMBA stellt nun das erste physiologische Organoidmodell vor, das alle wichtigen sich entwickelnden Herzstrukturen umfasst und den Forscher*innen ermöglicht, Herzerkrankungen und -entwicklung zu untersuchen.
Im Jahr 2021 präsentierte das Mendjan-Labor das erste kammerartige Herzorganoid, das aus menschlichen induzierten pluripotenten Stammzellen gebildet wurde. Diese selbstorganisierenden Herzorganoide, auch Kardioide genannt, rekapitulierten die Entwicklung der linken Herzkammer in den allerersten Tagen der Embryogenese. „Diese Kardioide waren ein Grundsatzbeweis und ein wichtiger Schritt nach vorn“, sagt Mendjan. „Während die meisten Erkrankungen bei Erwachsenen die linke Herzkammer betreffen, die sauerstoffreiches Blut durch den Körper pumpt, sind bei angeborenen Defekten meist andere Herzregionen betroffen, die für den Aufbau und die Aufrechterhaltung des Kreislaufs wichtig sind.“
In der neuen Studie baute das Team am IMBA seine früheren Arbeiten aus. Die Forscher*innen erstellten zunächst Organoidmodelle der einzelnen Herzstrukturen. „Dann fragten wir: Wenn wir alle diese Organoide gemeinsam entwickeln lassen, erhalten wir dann ein Herzmodell, das koordiniert schlägt wie das frühe menschliche Herz?“, erklärt Mendjan.
Entschlüsselung der menschlichen Herzentwicklung
Nachdem die Forscher*innen Organoide der linken und rechten Herzkammer und des Vorhofs zusammen gezüchtet hatten, bot sich Ihnen eine Überraschung: „Tatsächlich breitete sich ein elektrisches Signal vom Vorhof in die linke und dann in die rechte Herzkammer aus - genau wie in der frühen fötalen Herzentwicklung bei Tieren“, erinnert sich Mendjan. „Diesen grundlegenden Prozess haben wir nun erstmals in einem menschlichen Herzmodell mit all seinen Kammern beobachtet.“
Während das frühere Kardioidmodell es den Forscher*innen ermöglichte, die Form und die Gewebeorganisation der Kammern zu untersuchen, können sie mit den neu entwickelten Mehrkammer-Kardioiden noch weiter gehen und untersuchen, wie regionale Unterschiede in der Genexpression zu spezifischen Kontraktionsmustern der Kammern und der komplizierten Kommunikation zwischen ihnen führen.
Die Forscher*innen haben bereits Einblicke in die frühe Herzentwicklung gewinnen können, insbesondere wie das menschliche Herz zu schlagen beginnt - was bisher nicht verstanden wurde. „Wir haben gesehen, dass die Organoidkammern im Laufe ihrer Entwicklung einen komplizierten Tanz des Führens und Folgens durchlaufen. Zunächst führt die linke Herzkammer die entstehenden rechten Herzkammern und den Vorhof in ihrem Rhythmus. Wenn sich dann - zwei Tage später - der Vorhof entwickelt, folgen die Herzkammern der Führung des Vorhofs. Dies spiegelt wider, was bei Tieren zu beobachten ist, bevor die Schrittmacher den Herzrhythmus endgültig kontrollieren“, erklärt Alison Deyett, Doktorandin in der Mendjan-Gruppe und eine der Erstautor*innen der Studie.
Screening-Plattform für angeborene Herzkrankheiten und Therapie
Die Mehrkammer-Kardioide ermöglichen es den Forscher*innen auch, kammerspezifische Defekte zu untersuchen. In einem Proof-of-Principle hat das Mendjan-Team eine Screening-Plattform für Defekte eingerichtet, in der sie untersuchen, wie bekannte Teratogene und Mutationen Hunderte von Herzorganoiden gleichzeitig beeinflussen.
Thalidomid, ein bekanntes Teratogen beim Menschen, und Retinoid-Derivate - die bei der Behandlung von Leukämie, Psoriasis und Akne eingesetzt werden - sind dafür bekannt, dass sie beim Fötus schwere Herzfehler verursachen. Beide Teratogene lösten in den Herzorganoiden ähnliche, schwere kammerspezifische Defekte aus. In ähnlicher Weise führten Mutationen in drei kardialen Transkriptionsfaktorgenen zu kammerspezifischen Defekten, wie sie auch in der menschlichen Entwicklung beobachtet werden. „Unsere Tests zeigen, dass Mehrkammer-Kardioide die embryonale Herzentwicklung rekapitulieren und mit hoher Spezifität störende Auswirkungen auf das gesamte Herz aufdecken können. Wir tun dies mit einem ganzheitlichen Ansatz, indem wir mehrere Messwerte gleichzeitig betrachten“, fasst Mendjan zusammen.
In Zukunft können Mehrkammer-Herzorganoide für toxikologische Studien und zur Entwicklung neuer Medikamente mit herzkammerspezifischen Wirkungen eingesetzt werden. „Zum Beispiel sind Vorhofarrhythmien weit verbreitet, aber wir haben derzeit keine gute medikamentöse Behandlung. Ein Grund dafür ist, dass es bisher keine Modelle gibt, in denen alle Regionen des sich entwickelnden Herzens koordiniert zusammenarbeiten“, so Mendjan weiter. Und obwohl Herzfehler weit verbreitet und sogar die häufigste Ursache für Fehlgeburten sind, bleibt die individuelle Ursache oft unbekannt.
Aus Stammzellen von Patient*innen entwickelte Herzorganoide könnten in Zukunft Aufschluss über den Entwicklungsfehler geben und darüber, wie er behandelt und verhindert werden kann. Die Mendjan-Gruppe ist besonders daran interessiert, Mehrkammer-Herzorganoide zu verwenden, um die Herzentwicklung besser zu verstehen: „Wir haben jetzt eine Grundlage, um das weitere Wachstum und das Regenerationspotenzial des Herzens zu untersuchen.“
IMBA hat der HeartBeat.bio AG (www.heartbeat.bio), einem von Sasha Mendjan mitgegründeten Spin-Off Unternehmen des IMBA, eine exklusive Lizenz für die Mehrkammer-Herzorganoid-Technologie erteilt. Mehrere Forscher*innen von HeartBeat.bio trugen wissenschaftlich zu der neuen Publikation bei. Das Unternehmen verwendet die linksventrikuläre Kardioid-Technologie von IMBA bereits in einer vollautomatischen und integrierten 3D-Plattform zur Entdeckung von Medikamenten für verschiedene Formen der Herzinsuffizienz. Die Lizenzierung des Mehrkammermodells ermöglicht es HeartBeat.bio, sein Portfolio an Krankheitsmodellen weiterzuentwickeln und damit mehr Möglichkeiten für den Aufbau einer kardialen Drug Discovery Pipeline zu schaffen.
Originalpublikation: Clara Schmidt, Alison Deyett, Tobias Ilmer, Simon Haendeler, Aranxa Torres Caballero, Maria Novatchkova, Micheael A. Netzer, Lavinia Ceci Ginistrelli, Estela Mancheno Juncosa, Tanishta Bhattacharya, Amra Mujadzic, Lokesh Pimpale, Stefan M. Jahnel, Martina Cirigliano, Daniel Reumann, Katherina Tavernini, Nora Papai, Steffen Hering, Pablo Hofbauer and Sasha Mendjan. Multi-chamber cardioids unravel human heart development and cardiac defects. Cell. doi.org/10.1016/j.cell.2023.10.030
Anbieter