Steuerung der Zellaktivität mit Licht
Ein verbesserter „Molekularer Lichtschalter“ verspricht Hilfe für blinde, taube und herzkranke Menschen.
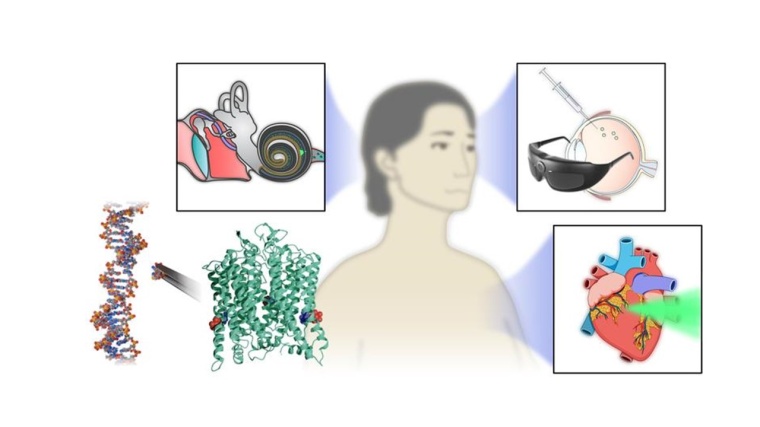
Göttinger Forscher des Exzellenzclusters Multiscale Bioimaging (MBExC) und des Else Kröner Fresenius Zentrums für Optogenetische Therapien der Universitätsmedizin Göttingen (UMG) entwickeln lichtempfindliches Protein, das den Seh- und Hörsinn wiederherstellen und den Herzrhythmus regulieren kann. Das Besondere: Es reichen bereits sehr geringe Lichtmengen aus, um diesen „molekularen Lichtschalter“ zu bedienen. Dies eröffnet neue Möglichkeiten für die Entwicklung innovativer Therapien zur Behandlung von Blindheit, Taubheit und Herzrhythmusstörungen. Die Ergebnisse wurden in der Fachzeitschrift Nature Biomedical Engineering veröffentlicht.
Die Optogenetik ist eine bahnbrechende Technologie, die lichtempfindliche Proteine, - Kanalrhodopsine, nutzt, um die Aktivität von Nerven- und Muskelzellen gezielt zu steuern. Die Baupläne für diese „molekularen Lichtschalter“ werden mittels spezieller Viren in die entsprechenden Zellen eingeschleust. Durch gezielt gesetzte Lichtpulse kann dann die Zellaktivität präzise an- und abgeschaltet werden. Das Feld der Optogenetik hat weltweit neue Möglichkeiten in der Grundlagenforschung, aber auch für die Behandlung von Erkrankungen eröffnet. Damit diese Technologie zur Entwicklung neuer Behandlungsmaßnahmen für beispielsweise herzkranke, schwersthörige und blinde Menschen genutzt werden kann, müssen sowohl die lichtempfindlichen Proteine als auch die Viren optimal angepasst werden, um den maximalen Nutzen und die erforderliche Sicherheit für die Anwendung beim Menschen zu gewährleisten.
Effizienz der optogenetischen Anregung gesteigert
Wissenschaftler des Göttinger Exzellenzclusters Multiscale Bioimaging (MBExC) und des Else Kröner Fresenius Zentrums für Optogenetische Therapien (EKFZ OT) haben jetzt die Entwicklung und Anwendung eines neuen, besonders vielversprechenden lichtempfindlichen Proteins beschrieben. Dieses von Dr. Thomas Mager, Arbeitsgruppenleiter am Institut für Auditorische Neurowissenschaften der Universitätsmedizin Göttingen (UMG), und Kollegen entwickelte neue Kanalrhodopsin trägt den Namen „ChReef“. „Durch die gezielte Veränderung des Bauplans dieses lichtaktivierbaren Proteins und den Einsatz von zum Teil roboterbasierten Analysemethoden, ist es uns gelungen, die Effizienz der optogenetischen Anregung deutlich zu steigern“, erklärt Dr. Mager. „Damit kommen wir einen ganzen Schritt weiter Richtung Anwendbarkeit beim Menschen, um den Seh- und Hörsinn wieder herzustellen und den Herzschlag zu regulieren“, so Prof. Dr. Tobias Moser, Direktor des Instituts für Auditorische Neurowissenschaften der UMG sowie MBExC- und EKFZ OT-Sprecher.













