Alphastrahler für die Krebstherapie
07.01.2023 - Forscher des Helmholtz-Zentrums Dresden-Rossendorf (HZDR) und der Palacký-Universität in Olmütz wollen die Behandlung von Prostatakrebs auf Basis von Actinium-225 verbessern.
In aktuellen Experimenten statteten sie radioaktiv markierte Substanzen mit Bindungsstellen für ein im Blutplasma vorkommendes Protein aus. So konnten sie im Mausmodell die Zirkulationszeit im Blut verlängern – mit der Folge, dass die Dosis der Alphastrahlung am Tumor steigt. Als nächstes planen die Forscher eine Therapiestudie, um Strategien zur Optimierung für die aktuell in der Klinik angewandte Nukleartherapie zu entwickeln. Die Forschungsarbeiten werden durch die Wilhelm Sander-Stiftung unterstützt.
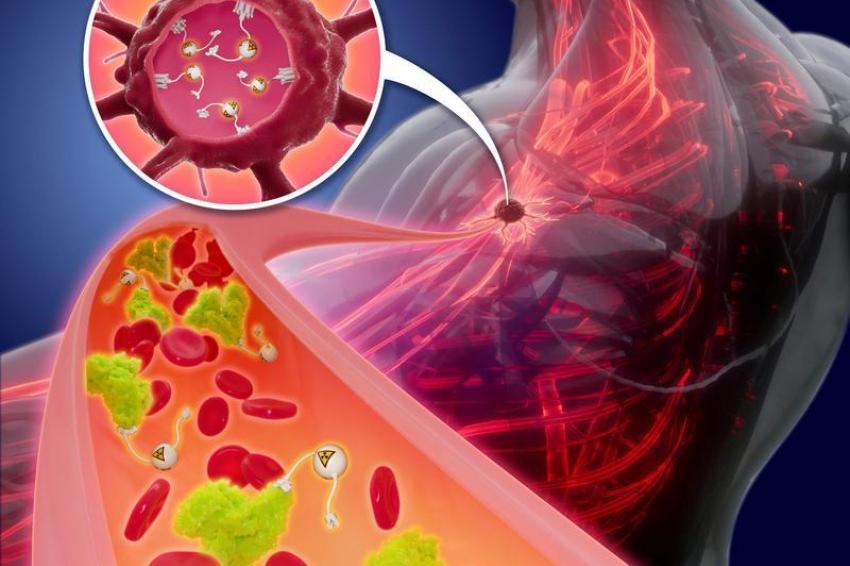
Eine Krebserkrankung wird in aller Regel operativ, mit chemotherapeutischen Medikamenten und/oder mit einer Strahlentherapie behandelt. Durch die Bestrahlung von außen wird aber auch gesundes Gewebe im Strahlengang angegriffen. Deshalb setzt man bei bestimmten Krebsarten auf Verfahren, bei denen die Strahlung von innen wirkt, direkt im oder am Tumor. Zu diesen lokal wirksamen Verfahren zählt auch die in der Nuklearmedizin eingesetzte Radionuklidtherapie, bei der radioaktive Substanzen in den Körper gebracht werden.
Besonders geeignet sind Alphastrahler, weil die beim radioaktiven Zerfall freiwerdende Energie so hoch ist, dass sie die Doppelstränge der DNA in den Tumorzellen irreparabel zerstört – die Zellen sterben infolge der Schäden ab. Zugleich beschränkt sich die Wirkung der Teilchen nur auf wenige Zellen, das umliegende Gewebe wird geschont. Ein weiterer Vorteil: Es werden auch kleine und kleinste Metastasen – Absiedlungen von Tumoren – erreicht, die die Strahlentherapie von außen nicht erfassen kann. Die Radionuklidtherapie kann somit die konventionelle Strahlentherapie gut ergänzen. Seit einigen Jahren rücken gerade die Alphastrahler verstärkt in den Fokus der Wissenschaft.
Ideale Zerfallseigenschaften für die Krebstherapie von innen
Actinium-225 ist ein Isotop des Elements Actinium, das der Gruppe der Actinoiden den Namen verleiht. „Das Isotop besitzt dank einer Zerfallsreihe mit vier Alphapartikel-Emissionen fast ideale Eigenschaften”, sagt Dr. habil Constantin Mamat, Leiter der Arbeitsgruppe Therapeutische Alphaemitter am HZDR-Institut für Radiopharmazeutische Krebsforschung. „Von Vorteil ist zudem die relativ lange Halbwertszeit von zehn Tagen. Allerdings verbleibt die Substanz mit dem Alphastrahler im Durchschnitt nur wenige Stunden im Körper, bevor sie wieder ausgeschieden wird. Ziel unserer aktuellen Studie war deshalb, die Verweildauer im Blut zu erhöhen.“
Damit das Actinium-225 punktgenau wirken kann, muss es in ein sogenanntes Radiokonjugat eingebaut werden, das aus einem Komplexbildner und einem Biomolekül besteht. Während der Komplexbildner oder Chelator die Aufgabe hat, das Radionuklid wie in einem molekularen Käfig möglichst stabil einzuschließen, da es sich ansonsten unerwünscht im Körper verteilt, muss das zielsuchende Biomolekül extrem spezifisch und hochaffin an Rezeptoren der Tumorzellen im Körper andocken. Das Radionuklid reichert sich daraufhin am Tumorgewebe an und entfaltet ausschließlich dort seine zerstörende Wirkung.
Größerer Molekülkomplex erhöht Verweildauer im Blut
In einer jetzt im Fachmagazin „Theranostics“ veröffentlichten Studie setzten die Forscher auf eine zusätzliche Bindungsstelle für ihr bereits zuvor entwickeltes Radiokonjugat. Die Idee: Das Biomolekül bindet an das häufigste Protein im Blutplasma, das Albumin. Durch diese Anbindung vergrößert sich der Molekülkomplex, die Nieren können ihn nicht so schnell aus dem Blut herausfiltern und die Dauer, im Blut zu verbleiben, steigt an.
Grundlage für die neuen Experimente war die im Rahmen der ersten Studie gelungene Verknüpfung von Actinium-225 mit einer zielsuchenden Einheit, die spezifisch an den PSMA-Rezeptor von Prostatakrebszellen andockt. PSMA steht für „Prostata-spezifisches Membranantigen”, ein Protein in der Zellmembran von Prostatazellen. Der Rezeptor ist in den Zellen des Prostatakarzinoms sehr viel häufiger zu finden als in den gesunden Zellen der Prostata. In anderen Körperzellen kommt das Protein praktisch nicht vor. Damit ist PSMA der ideale Ansatzpunkt, um Prostatakrebszellen gezielt mit einem Radiokonjugat auf Basis von Actinium-225 anzusteuern.
Damals ging es darum, einen standardmäßig in der Klinik genutzten Komplexbildner so zu optimieren, dass er das Actinium-225 bei niedrigen Temperaturen schnell und stabil einschließt. Die Forschungsgruppe entwickelte zum Vergleich zwei Radiokonjugate: eines mit einer, das andere mit zwei zielsuchenden Einheiten für PSMA. Im Tiermodell erwiesen sich beide als stabil. „Zwei Biomoleküle für PSMA – das konnten wir damals zeigen – erhöhen die Affinität der Bindung an die Rezeptoren der Krebszellen”, beschreibt Dr. Falco Reissig, Chemiker in Mamats Arbeitsgruppe, eine wichtige Erkenntnis der Untersuchung.
In der zweiten Studie testeten die Forscher nun ebenfalls zwei Varianten: Eine Variante mit der vorhandenen Andockstelle für den PSMA-Rezeptor sowie einem neuen Biomolekül für Albumin und eine zweite Variante mit jeweils zwei Andockstellen für PSMA und Albumin. „Das Ergebnis war mehr als überzeugend. Beide Varianten haben die Verweildauer im Vergleich zu den Komplexen ohne Albuminbinder aus der ersten Untersuchung im Maximum um drei bis vier Tage verlängert. Im Tumorgewebe der Mäuse finden wir eine bis zu zehnfach höhere Anreicherung des Actinium-225-haltigen Radiokonjugates“, fasst Mamat zusammen.
Allerdings schießt die zweite Variante mit jeweils zwei Biomolekülen für PSMA und Albumin etwas über das Ziel hinaus. Die im Vergleich zur ersten Variante besseren Werte für die Verweildauer sind mit einem Nachteil verbunden: „Bei diesem Radiokonjugat ist die Anreicherung in gesundem Gewebe wie etwa den Ausscheidungsorganen ebenfalls erhöht, was wir natürlich nicht wollen”, sagt der an der Studie beteiligte Biologe Dr. Kristof Zarschler.
Damit erweist sich das Radiokonjugat mit jeweils einer Bindungsstelle für Albumin und PSMA als der bessere Kandidat für eine Radionuklidtherapie. Doch auch in der ersten Untersuchung schnitt ein Molekülkomplex gut ab: derjenige mit zwei Bindungsstellen für PSMA, allerdings ohne Albuminbinder. Deshalb will die deutsch-tschechische Forschungsgruppe im nächsten Schritt die beiden vielversprechenden Substanzen aus beiden Studien in einer Therapiestudie im Tiermodell vergleichen. „Wir wollen herausfinden, wie viel Radioaktivität wir einem Tier injizieren müssen, um das Tumorwachstum aufzuhalten oder vielleicht ein Schrumpfen des Tumors zu sehen”, beschreibt Mamat die weiteren Ziele. „Im Blick haben wir zudem etwaige Nebenwirkungen wie etwa Schädigungen an den Nieren, über die das Radiokonjugat ausgeschieden wird. Wir hoffen, dass wir dann aus den beiden Kandidaten einen auswählen und vielleicht sogar eine erste Therapiestrategie für Anwendungen im Patienten entwickeln können.”