Verleihung des Hygiene-Preises und der Hygieia-Medaille
31.05.2022
- Neues Biofilm-Modell zur Beurteilung der Effektivität von antimikrobiellen Substanzen gegen Wundbiofilm
Der renommierte Hygiene-Preis der Rudolf-Schülke-Stiftung wurde in diesem Jahr an die Autoren der wissenschaftlichen Veröffentlichung mit dem Titel „Comparative analysis of biofilm models to determine the efficacy of antimicrobials“ verliehen [1]. Der mit 15.000 € dotierte Preis wurde im Rahmen eines Festakts an die Professorin Ewa K. Stürmer, Leiterin der Arbeitsgruppe, und Professor Ralf Smeets, beide tätig am Universitätsklinikum Hamburg-Eppendorf, übergeben. Mit dieser herausragenden Arbeit konnte gezeigt werden, dass sich das neu entwickelte Biofilm-Modell auf Schafsblutbasis für die standardisierte und realitätsnahe Wirksamkeitsprüfung von antimikrobiellen Wirkstoffen auf mit Biofilm besiedelten Wunden eignet. Für die Zukunft ergeben sich damit bessere Optionen für die Behandlung von Wundbiofilmen und für die Wirksamkeitsprüfung neuer antimikrobieller Substanzen.
Wundbiofilme behindern die Heilung chronischer Wunden
Auch wenn Wundheilungsstörungen und chronische Wunden für viele Menschen Alltag sind, ist dieses Thema in der nicht-betroffenen Allgemeinbevölkerung eher nicht sehr bekannt und auch in der Presse wenig beachtet.
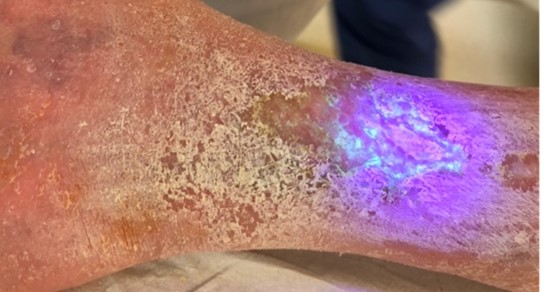
Basierend auf unterschiedlichen internistischen, dermatologischen und immunologischen Erkrankungen leiden in den westlichen Ländern ca. 2% der Bevölkerung unter chronischen Wunden, das heißt Wunden, die trotz adäquater Behandlung innerhalb von 6 Wochen nicht geheilt sind. Ein häufiger Auslöser für Störungen des Heilungsprozesses sind Biofilme (Abbildung). Sie können sich innerhalb von 24 bis 48 h auf der Wunde bilden. Biofilme sind komplexe vernetzte Gemeinschaften aus Bakterien, Pilzen oder anderen Mikroorganismen, die zusammen mit Proteinen und Zuckerstoffen eine gelartige Matrix bilden. Diese kann sowohl an unbelebten Oberflächen, wie beispielsweise an der Innenwand von Duschschläuchen, haften, als auch an vitalem Gewebe einer Wunde. Dort lösen Biofilme chronische Entzündungen aus, wodurch auch gesunde Gewebsstrukturen geschädigt und die Wundheilung stark behindert werden können.
Eine Metaanalyse aus 2016 zeigte [2], dass etwa 80% chronischer Wunden mit pathogenen Mikroorganismen in einem Biofilm besiedelt sind. Die Entfernung der bakteriellen Belastung und des Biofilms einer chronischen Wunde, also die Beseitigung der chronischen Inflammation, ist der erste Schritt in der Lokaltherapie, so Prof. Stürmer. Erst wenn diese erfolgreich ist, können positive Einflüsse, wie z.B. Wachstumsfaktoren, MMP-Blocker oder auch autologe Stammzellen effektiv in die in die stagnierende Wundheilung eingreifen. Die schleimartige Matrix des Biofilms erschwert jedoch das Vordringen von antiseptischen (und antibiotischen) Wirkstoffen zu den Mikroorganismen, um diese zu eradizieren. Wundspüllösungen, die planktonische, d.h. „freischwimmende“ Bakterien töten, erzielen in Biofilm-Konstrukten meist nicht die gleiche Wirkung. In der derzeit in Novellierung befindlichen S3-Leitlinie zur Lokaltherapie chronischer Wunden der Deutschen Gesellschaft für Wundheilung (DGfW) wird die Qualität der Evidenz für die Anwendung von Antiseptikalösungen zur Wundreinigung bei erregerbedingten Entzündungen als gering eingeschätzt [3]. Verlässliche Maßnahmen, die immer wiederkehrende bakterielle Besiedlung und die Neubildung von Biofilm nachhaltig zu beherrschen, fehlen bisher. Das Wunddébridement steht als Mittel der Wahl derzeit im Vordergrund.
Biofilm-Modell auf Schafsblut-Basis geeignet als standardisiertes Prüfmodell
Ausgangspunkte für Frau Prof. Stürmers Forschungsarbeit war die Feststellung, dass das humane Biofilm-Modell hpBIOM (individueller humaner Spender), das bisher zur Bewertung der Wirksamkeit von Wundantiseptika in ihrer Arbeitsgruppe verwendet wurde, speziellen Laboratorien vorbehalten ist, weil stets ein positives Ethik-Votum für die jeweiligen Anwender und die Einwilligung der jeweiligen Blutspender erforderlich wäre. Damit eignet sich hpBIOM nicht für eine flächendeckende, standardisierte Wirksamkeitstestung von antimikrobiellen Substanzen.
In der jetzt mit dem Hygiene-Preis ausgezeichneten Publikation [1] hat das Autorenteam die Wirksamkeit verschiedener Antiseptika bei Vorliegen eines Wundbiofilms mittels drei verschiedener Biofilm-Modelle überprüft. Es wurden zwei 3D-Biofilm-Modelle, eines auf der Basis von menschlichem Plasma mit Immunzellen (lhBIOM) und eines auf Basis von Schafsblut (sbBIOM) mit hpBIOM hinsichtlich der mikroskopischen Struktur des Biofilms (Rasterelektronenmikroskopie; REM) und ihrer bakteriellen Toleranz gegenüber Wundspüllösungen auf Basis von Octenidinhydrochlorid bzw. von Natriumhypochlorit/hypochlorige Säure verglichen. Das Tier „Schaf“ wurde gewählt, weil bereits in der DIN EN 13727 Schafserythrozyten als erhöhte Herausforderung in der Bestimmung der Effizienz eines antimikrobiellen Produktes eingesetzt werden. Als Testorganismen wurden S. aureus und P. aeruginosa verwendet.
Es zeigte sich zum einen, dass das sehr viel leichter flächendeckend zu nutzende Biofilm-Modell auf Basis von Schafsblut strukturell und im Wirkprofil mit den humanen Modellen vergleichbar ist und sich daher sehr gut als praxisnahes Modell für die Zulassung (neuer) antimikrobieller Wirkstoffe durch akkreditierte Laboratorien eignet. Zum anderen konnte im direkten Vergleich zwischen einer Wundspüllösung, die Natriumhypochlorit und hypochlorige Säure enthält, und Octenisept (arzneilich wirksame Bestandteile: Octenidinhydrochlorid und Phenoxyethanol) klar belegt werden, dass die hypochlorige Wundspüllösung nur eine sehr geringe bis keine Wirksamkeit in den Biofilm-Modellen erzielte. Octenisept war hingegen in allen drei Biofilm-Modellen wirksam.
Im Biofilm-Modell auf Schafsblutbasis konnte Octenisept z.B. die Keimzahl von P. aeruginosa, dem resistenteren der beiden Testorganismen, bei einer Ausgangskeimzahl von 1,5x106 KBE/Modell nach 24 h um 2 log10-Stufen, nach 48 h um 7 log10-Stufen reduzieren und nach 72 h vollständig eliminieren. Zudem konnten im Rasterlektronenmikroskop deutliche Fissuren im Biofilm nach Gabe von Octenisept detektiert werden. Prof. Stürmer geht davon aus, dass die Zusatzstoffe in Octenisept dabei eine wesentliche Rolle spielen, da einige das Potenzial haben, Proteine oder Zucker im Biofilm zu spalten.
Forderung nach stärkerer Wahrnehmung Translationaler Forschung
Prof. Dr. Ewa Stürmer ist Fachärztin für Chirurgie, Orthopädie und Unfallchirurgie und eine anerkannte qualifizierte Expertin auf dem Gebiet der Translationalen Wundforschung. Seit 2020 ist sie Oberärztin und Leiterin des Comprehensive Wound Centers der Klinik und Poliklinik für Gefäßmedizin des universitären Herz- und Gefäßzentrums des Universitätsklinikums Hamburg-Eppendorf.
Ihr translationaler und klinischer Forschungsschwerpunkt liegt seit vielen Jahren auf dem „Wundbiofilm“. Es geht ihr dabei nicht nur darum, anhand eines humanen Biofilm-Modells auf Blutplasma-Basis neue Therapieoptionen zu entwickeln, sondern auch darum, die hohe Toleranz des Biofilms gegen externe „Kräfte“ durch interbakterielle Kommunikationen zell- und molekularbiologisch zu analysieren. Es sei ihr wichtig, so Prof. Stürmer, dass die transnationale Forschung stärker wahrgenommen wird. Diese Forschung, betont sie, ist ein wichtiges Bindeglied zwischen klinischer Forschung und Grundlagenforschung. Sie verliert den klinischen Alltag nicht aus dem Blick und "forscht" nah an Patienten, fokussiert also, was den Anwendern von Nutzen sein kann. Deshalb steht die Translationale Forschung oft zwischen den Stühlen und wird weniger gefördert als Grundlagenforschung einerseits und Klinische Forschung andererseits.
In seiner Laudatio für die Preisträgerin würdigte Priv.-Doz. Dr. Albert Pitten, Institut für Krankenhaushygiene und Infektionskontrolle Gießen und stellvertretender Vorsitzender der Rudolf-Schülke-Stiftung, die Originalität, Methodik und Relevanz der Studie sowie das außerordentliche wissenschaftliche Engagement der Preisträgerin, z.B. bei der Betreuung von bereits über 70 medizinischen, zahnmedizinischen und pharmazeutischen Doktoranden. Durch die Entwicklung des Biofilm-Modells auf Schafsblutbasis, das nahe an der Realität des humanen Wundbiofilms in vitalem Gewebe liegt, kann zukünftig die Wirksamkeit von antimikrobiellen Substanzen für die Anwendung auf chronischen und in der Regel mit Biofilm besiedelten Wunden standardisiert geprüft und bewertet werden.
Der Hygiene-Preis mit der Urkunde wurde am 20. Mai 2022 in Hamburg im Rahmen des Festakts zum 50jährigen Jubiläum der Rudolf-Schülke-Stiftung an Prof. Stürmer und Herrn Prof. Smeets, Mitautor und stell-vertretender Direktor der Klinik und Poliklinik für Mund-, Kiefer-, und Gesichtschirurgie des Universitätsklinikums Hamburg-Eppendorf, überreicht. Der mit 15.000 € dotierte Hygiene-Preis ist nicht nur finanziell attraktiv, sondern unterstützt Wissenschaftler auch bei der Bewerbung für wichtige Positionen wie u.a. Lehrstühlen an deutschen Universitäten. In dem hervorragenden Festvortrag von Prof. Stürmer mit dem Titel „Fallstricke in antimikrobiellen Wirkprofilen“ wurde unmittelbar deutlich, weshalb diese Arbeit preiswürdig ist. In ihrer Zusammenfassung wies Prof. Stürmer auch darauf hin, dass durch die Entwicklung des Schafsblut-Biofilmmodells zukünftig ein Verzicht auf Tierversuche bei „Anti-Bioilm“-Fragestellungen möglich sein wird.
Literatur
- Stürmer EK, Besser M, Brill F, Geffken M, Plattfaut I, Severing AL, Wiencke V, Rembe JD, Naumova EA, Kampe A, Debus S, Smeets R. Comparative analysis of biofilm models to determine the efficacy of antimicrobials. Int J Hyg Environ Health. 2021 May;234:113744. doi: 10.1016/j.ijheh.2021.113744. Epub 2021 Mar 26. PMID: 33780904.
- Heyer K, Herberger K, Protz K, Glaeske G, Augustin M. Epidemiology of chronic wounds in Germany: Analysis of statutory health insurance data. Wound Repair Regen. Mar 2016;24(2):434-442.
- Deutsche Gesellschaft für Wundheilung (Hrsg.). S3-Leitlinie zur Lokaltherapie chronischer Wunden bei Patienten mit den Risiken periphere arterielle Verschlusskrankheit, Diabetes mellitus, chronisch venöse Insuffizienz. Abgerufen am 24. Mai 2022, https://www.awmf.org/leitlinien/detail/ll/091-001.html
Kontakt
Rudolf Schülke Stiftung
Robert-Koch-Straße 2
22851 Norderstedt
Deutschland
+49 40 52100562
+49 40 52100577











